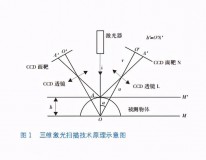
21种颅脑影像征象。
常春藤征
该征是指烟雾病患者MR检查增强扫描时图像上观察到沿柔脑膜分布的点状或线状强化信号影,因类似爬行在石头上的常春藤而命名。文献报道这种征象出现率约70%,并提出其对烟雾病的诊断具有特异性。
其形成主要是双侧颈内动脉、大脑前、中动脉狭窄或闭塞后,颈外动脉及椎-基底动脉系统参与代偿性供血的侧支循环血管,包括大脑后动脉、脑膜中动脉、颞浅动脉、枕动脉,沿双侧大脑皮层柔脑膜分布。
有研究报道FLAIR图像亦可观察到常春藤征,表现为柔脑膜弥漫性高信号改变。FLAIR序列是水信号为零时的反转脉冲序列,由于FLAIR能够有效地克服脑脊液在T2WI呈高信号所致的部分容积效应和伪影的影响,敏感地反映蛛网膜下腔轻微信号强度的改变,对蛛网膜下腔病变如蛛网膜下腔出血、脑膜炎和脑膜转移瘤等比常规T2WI敏感。
在烟雾病患者FLAIR图像上的常春藤征的产生机制仍未完全清楚,目前存在几种不同的说法:
脑底异常血管网和脑表面代偿性侧支循环血管与柔脑膜血管吻合,形成皮层柔脑膜侧支血管网,由于其血流速度缓慢,而表现为高信号;
皮层软脑膜侧支吻合血管网的柔脑膜动脉扩张;
皮层柔脑膜充血、水肿、增厚。
有研究者观察到有效的血管重建术后烟雾血管和皮层柔脑膜点状或线状高信号减少甚至消失,患者临床症状明显改善,提示FLAIR图像上柔脑膜点状或线状高信号信号改变为皮层柔脑膜血管充血、水肿和增厚。
这种表现是由于颈内动脉及大脑中动脉狭窄、闭塞后,颈外动脉及椎-基底动脉系统参与代偿性供血,通过DSA检查可见扩张的颈外动脉系统及大脑后动脉参与形成的柔脑膜侧支血管网,颈内动脉狭窄或闭塞程度越严重,柔脑膜高信号的范围越广泛,其常春藤征表现越明显。
常春藤征的轻重与病情进展情况有关。根据DSA表现,烟雾病的病程分为6个阶段:
颈内动脉分叉段狭窄,通常为双侧性,仅见颈内动脉末端和(或)大脑前、中动脉起始段狭窄;
颅底异常血管网形成;
颅底烟雾状血管更明显,大脑前、中动脉进一步狭窄或闭塞;
随病程进展,烟雾状血管开始减少,经颈外动脉代偿供血增加;
第4阶段进一步进展;
颅内主要动脉完全消失,颅底异常血管网亦消失,此时大脑主要依靠颈外动脉代偿供血。
由于常春藤征的形成主要是一侧或双侧颈内动脉、大脑前、中动脉狭窄或闭塞后,颈外动脉及椎-基底动脉系统参与代偿性供血的侧支循环血管,故常春藤征主要在病程后期才出现。
常春藤征在各期表现程度不同,部分FLAIR图像未见到常春藤征,可能有二种原因:
由于其颈内动脉闭塞后侧支循环形成不足,代偿能力差,此时可见脑实质内改变明显,本研究中表现为大面积脑梗死、脑出血的患者FLAIR图像上均未见常春藤征。
病情较轻,未形成完整的侧支循环血管。
常春藤征首先于烟雾病患者MR增强扫描图像上观察到。
有人指出T1增强扫描在诊断烟雾病中比FLAIR图像更有优势,比较增强扫描所获得图像与同一病例的FLAIR图像,当FLAIR图像上柔脑膜高信号分布范围较小而散在分布时,在T1W增强扫描图像上可以见到明显常春藤征象,但在后者上较难鉴别正常强化的脑膜血管或烟雾病侧支循环血管。
另外,FLAIR图像能清晰显示脑内缺血灶、梗死灶、脑软化灶等继发性脑实质改变。在烟雾病患者,常春藤征需与脑膜炎及蛛网膜下腔出血鉴别。
脑膜炎在病理上主要是脑膜增厚及肉芽组织增生,其诊断主要根据临床表现及脑脊液检查,部分患者MR FLAIR图像上可见脑膜高信号表现,可错认为常春藤征,但脑膜炎病变主要分布脑颅底及双侧颞叶,鞍上池脑膜明显,有时可见邻近脑实质受累呈高信号。
蛛网膜下腔出血患者MR FLAIR图像上亦可见到线状高信号改变,但其主要分布在蛛网膜下腔,沿脑沟分布,柔脑膜未见高信号,容易与常春藤征混淆,结合T1WI有助于鉴别诊断。烟雾病患者MR FLAIR图像常春藤征,主要分布在额顶叶。鞍上池脑膜明显,有时可见邻近脑实质受累呈高信号。

硬脑膜尾征
在增强的MRI或CT图像上,表现为强化并增粗的硬脑膜从肿块延伸出来,长0.5~3cm,形似一条尾巴,称作脑膜尾征或脑膜征,也叫硬膜尾征。
硬脑膜尾征是脑膜瘤较常见的增强MRI表现,最初有人提出硬脑膜尾征是来源于肿瘤的直接侵犯,但后来许多研究显示硬脑膜尾很少或没有肿瘤的累及,也有人认为是硬脑膜的反应性改变。目前认为肿瘤侵犯和富血管反应双重机制是产生硬脑膜尾征的原因。
脑膜瘤为颅内常见肿瘤,肿瘤起病慢,病程长。典型脑膜瘤多为圆形或类圆形,少数为不规则形,边界清楚锐利。
CT平扫大部分表现为均匀高密度15%~20%含钙化,甚至有的完全钙化。25%~30%表现为等密度,常因占位效应或病灶周围水肿而发现。少部分脑膜瘤表现为低密度,多为肿瘤的囊变、坏死所致,少数为胶原纤维化、陈旧性出血或较多的脂肪沉积所致;约10%的脑膜瘤为混合密度,常见瘤周水肿。
CT增强扫描除钙化较明显的砂粒型脑膜瘤可能不增强或增强较少外,肿瘤的实质部分往往呈较明显的均匀增强化。
大多数脑膜瘤MRI表现为T1WI呈稍低或等信号,T2WI呈稍高或等信号。脑膜瘤内部信号常不均匀,表现为颗粒状、斑点状,这些与肿瘤内血管、钙化、囊变和砂粒体及肿瘤内纤维分隔有关。增强扫描时,脑膜瘤立即发生显著增强并有延迟强化,持续时间达30~60分钟。
确定有没有硬脑膜尾征有3个标准:
硬脑膜尾巴应该在经过肿瘤的2个连续的断面仁见到;
硬脑膜尾巴应该从肿瘤向外光滑地逐渐变细;
硬脑膜尾征应该比肿瘤本身强化更明显。
因此,他们认为“硬脑膜尾征”是脑膜瘤高度特异性征象。尽管很多研究表明“硬脑膜尾征”的出现至少高度提示脑膜瘤的存在,但仍有很多病例报道“硬脑膜尾征”也见于一些非脑膜瘤的肿瘤。
比如转移瘤、肉芽肿性脑膜炎(又叫非化脓性脑膜炎,主要包括结核、真菌、嗜酸性肉芽肿、韦氏肉芽肿、肥厚性硬脑膜炎)、血管外皮细胞瘤、淋巴瘤、绿色瘤、胶质母细胞瘤、少突胶质细胞瘤、听神经瘤、乳头状中耳肿瘤、结节病、色素瘤以以及术后改变和放疗等。
关于为什么有些肿瘤会引起硬脑膜尾、有些肿瘤不会有,这个问题从文献上并没有明确的答案。有学者认为脑膜瘤“硬脑膜尾征”的出现有的与肿瘤侵犯有关,有的与富血管反应有关。
但这两种解释也适用于非脑膜瘤肿瘤出现的“硬脑膜尾征”。但无论怎么解释,“硬脑膜尾征”仍然是提示脑膜瘤的一个有帮助的征象。

三角征
又名楔形征或倒三角形征。累及大脑皮质或皮质-皮质下白质的幕上病灶,以大脑表面为基底,尖部指向大脑深部,呈三角形或楔形,称为三角征。病灶往往边界清晰,无瘤周水肿,无或有轻微占位效应。
MRI上胚胎发育不良性神经上皮瘤(DNT)表现为边界清楚的三角形(“三角征”)假囊肿样病变,位于皮层(可累及皮层下)或深部皮质核团,有时也可表现似肥大扩张的肥皂泡状巨脑回状;T1WI上呈低信号,T2WI上为高信号;增强无强化或轻度强化;瘤内可见条索状从边缘向中心延伸的等信号分隔;无瘤周水肿,无占位效应;由于肿瘤位于脑表面,常可引起邻近颅骨内板发育不良而变形重构等继发性改变。
有些作者认为,“三角征”(也称“楔形征”,指肿瘤以人脑表而为基底,尖指向人脑深部,呈楔形)和瘤内分隔是DNT的特征性征象,并认为,“三角征”可能与神经胶质纤维通路放射状分布有关,瘤内分隔可能与肿瘤分叶状表现有关。
诊断与鉴别诊断:
影像学上低级别星形细胞瘤、少枝胶质细胞瘤、神经节细胞胶质瘤、蛛网膜囊肿和表皮样囊肿,有时与DNT表现类似,T1WI为低信号,T2WI为高信号,无瘤周水肿,无占位效应,增强无强化,较难鉴别。
但是低级别星形细胞瘤常发生于20~40岁,深部白质为主,无“三角征”和瘤内分隔,可与DNT区分。
少枝胶质细胞瘤多见于成人,额叶多见;虽然也位于人脑表而,但多伴有钙化,典型钙化呈条索状沿脑回分布;有时可伴有瘤周水肿和瘤体强化;同时“三角征”和瘤内分隔更是难以同时出现;因此也可与DNT相鉴别。
神经节细胞胶质瘤也多见与儿章,多有长期癫病发作病史;也常见于颖叶,但多位于皮层下区,影像学上常表现为囊实性,增强实性部分多呈不均匀强化;钙化也远较DNT常见,而“三角征”和瘤内分隔少见,因此可资与DNT相鉴别。
蛛网膜囊肿和表皮样囊肿为脑外病变,具有脑外占位的征象(如皮质受压、蛛网膜下腔增宽等);同时,蛛网膜囊肿一般张力较大,T1WI、 T2WI和T2水抑制像上始终与脑脊液信号一致,可与DNT相鉴别;表皮样囊肿ADC图一般呈低信号,而且“三角征”和瘤内分隔同时出现也未见报道。

脑血管高密度征
此征可出现在颅内任何动脉、甚至静脉,是CT平扫动脉闭塞的早期直接征象,代表血栓形成或栓塞,对脑梗死的早期诊断和指导治疗有一定的意义。
脑动脉高密度征最常见的为大脑中动脉高密度征(HMCAS),其次是基底动脉高密度征(HBAS)。这是因为大脑中动脉(MCA)血栓形成或栓塞引起的脑梗死最常见,占脑梗死的一半左右。
另外这些动脉走行区有脑脊液,增强了组织间对比。应该指出脑动脉局部、非对称性高密度是早期脑梗死的可靠征象,若两侧动脉对称性密度增加,血栓栓塞的可能性小。
HMCAS脑梗死多呈非对称性高密度征,多发生在MCA第1段和第2段,发生在第2段呈“圆点征”或“破折号征”。有文献报道非对称性HMCAS提示血栓栓塞准确度16%~64%不等。
大脑前动脉和大脑后动脉血栓栓塞并动脉粥样硬化性疾病,沿血管壁或动脉腔内出现密度增加的粥样斑块;部分斑块出现钙化,CT值可达97~221HU,可能是导致脑动脉高密度征假阳性的原因之一。
从理论上讲,若正常动脉周围为透光区,正常的血管可显示为高密度,尤其在脑底部走行于低密度脑脊液中的动脉。因此动脉腔内高凝状态(平均红细胞比容增高,在高血压和糖尿病发生率高)引起动脉表观密度增加或邻近脑组织密度减低(如脑水肿),也可能导致脑动脉高密度征假阳性的出现。
也有人指出脑动脉高密度征出现原因可能是正常、或高凝血状态或血管壁的微钙化、邻近脑组织低密度等。因此脑动脉高密度征患者还应有脑区域梗死证据。
另外,脑动脉高密度征还可见于蛛网膜下腔出血、脑萎缩、脑白质疏松症、血管神经性头痛和神经官能症等。因此,需严格掌握脑动脉高密度征的诊断标准,能否成为早期溶栓治疗指征,应密切结合临床来决定。
脑动脉高密度征的检出率与检查时间以及CT的分辨力有关。脑动脉高密度征可能是短暂、一过性现象,在发病早期HMCAS阳性率较高。
有报道脑梗死发病后90min可见到脑动脉高密度征,但也有作者认为在发作时即可见到脑动脉高密度征。HMCAS消失的原因一般认为是血栓溶解或逐渐演变成等密度。另外层厚和CT分辨力也与HMCAS检出率有关。层厚越薄,越容易发现。
脑动脉高密度征是脑梗死最早期征象之一,可是否能作为溶栓和判断溶栓效果的指标,还存争议。
多数研究认为,HMCAS与脑梗死临床表现严重程度密切相关,HMCAS阳性患者较阴性者死亡率高,易出现大梗死灶、严重脑水肿、颅高压,较少患者完全康复和留下轻微后遗症。有些报道HMCAS阳性6h内用溶栓治疗比传统治疗预后明显改善;也有人认为MCAS特异性太低,不能作为溶栓指标。
另外脑动脉高密度征不仅可以评价治疗效果,更重要的是对于预后的准确判断以及可以帮助医生制订合理的治疗方案。脑梗死超早期可能仅有临床表现和HMCAS,因此,研究HMCAS预测脑梗死预后的价值显得尤为重要。
总之,脑动脉高密度征是急诊平扫CT预测动脉内血栓形成和梗死发生最早和最有用的征象之一。但脑动脉高密度征并不总是代表原位血栓,在临床评价中应执行更严格的诊断标准,密切结合临床,减少可能的假阳性。

上二图示大脑中动脉中心点征,后临床均证实为大脑中动脉栓塞。下左图平扫示左侧大脑中动脉M2段5mm高密度,与脑室质密度差异不明显(箭);下右图CTA示相应部位充盈缺损(箭)
轨道征
在头颅CT片上表现为脑回样、曲线状、平行的钙化密度影。Sturge-Weber综合征是一种胚胎期血管神经发育异常所致的神经斑痣血管瘤病。
一般认为正常胚胎第8周时围绕神经管头部发展的血管丛已退化,但在Sturge-Weber综合征患者血管丛仍存在,导致了覆盖于脑皮质外层的软脑膜血管瘤病和半侧面部血管瘤病。
这些血管畸形由位于软脑膜与蛛网膜之间间隙内的单纯血管结构组成。血管丛存在及退化的程度决定了是否累及双侧,也可出现单侧软脑膜血管瘤而面部未受累。
一种比较简单的理论认为颅面血管瘤病(SWS)的最初缺陷发生于形成分层的早期,这时在发育中的皮质静脉(脑循环)与上矢状窦(硬膜和颅盖循环)之间应该有一正常持续的连接,如果在这两个区域循环的分化和分离过程中这一交通不再存在,脑皮质的静脉引流就会受到破坏,结果受累区域的脑循环将会代谢不足,软脑膜血管畸形下的脑皮质通常会发生功能障碍、进行性萎缩和钙化。
组织学上,面部皮肤血管瘤的血管壁类似于胚胎型毛细血管壁,缺少弹力层和基层。颅内病理改变主要为覆盖于大脑皮层的软脑膜静脉血管瘤、单侧皮层钙化、偏侧性脑萎缩,病变区神经节细胞减少、变性,胶质细胞增生和脱髓鞘样改变。
软脑膜血管瘤由薄壁静脉型血管组成,局限于软脑膜。皮层钙化灶一般位于软脑膜血管瘤下方,可延伸至下方的白质,并认为钙化是由于脑血管瘤的存在使血管渗透压的停滞及异常引起内皮、外皮及神经胶质细胞体的缺氧性损伤、钙质沉积所致。
■ 钙化
文献认为,钙化的部位一般位于与面部血管瘤同侧的顶、枕叶,呈 “双轨状”或 “脑回状”。
钙化形态从点状到“脑回状”,数量可从一叶小点状到多叶广泛钙化,能否说明钙化可以从无到有、从小到大、从点状延续至“脑回状”,呈动态发展过程;在未发生钙化之前,CT平扫可呈阴性。一般认为钙化显示与否与时间有关。
■ 脑萎缩
表现为患侧颅腔较对侧窄小,大脑皮层变薄,脑沟增宽,脑回变细,蛛网膜下腔显著扩大,侧脑室的扩大,中线结构的平行移位。
其发生机制也与软脑膜血管瘤导致皮层血液循环异常、缺氧,神经节细胞减少、变性有关。
脑萎缩的程度与皮层钙化的多少不成正相关。CT能直接反映脑皮质萎缩的部位和程度,可间接推断病情的严重程度。
■ 增强CT征象
Sturge-Weber综合征的病理基础是大脑皮层软脑膜的静脉血管瘤,故增强CT可显示强化现象。
增强检查显示钙化灶周围“脑回状”中等度强化。文献报告可有患侧脉络丛增大、强化,髓质静脉、室管膜下静脉增粗。
MRI可检出不同成分的钙化,钙化在T2WI、T1WI均可呈高、等、低各种信号,但常为低信号。
虽然脑回样(线状、旋绕状或蛇状)钙化也可以由梗死、胶质瘤、结节性硬化、化脓性脑膜炎、白血病(鞘内注射甲氨蝶吟和颅脑照射后)、钙化性脑膜脑病及蛛网膜下脂肪等引起,但有典型的车轨状钙化(车轨征)并结合相关临床表现,常可提示Sturge-Weber综合征。

半球间裂征
胼胝体是连接两侧大脑半球的最大连合纤维,位于大脑纵裂底部,组成胼胝体的纤维向两半球内部的前、后、左、右辐射,连系额、顶、枕、颞叶,形成两侧侧脑室顶部。
在MR矢状位上胼胝体呈典型的曲线状,边缘光滑,其嘴、膝、体及压部均清晰可辨,其后端叫压部,中间叫体,前方弯曲部叫膝,膝向下弯曲变簿叫嘴。
以前曾认为胼胝体形成顺序是膝部最先形成,继而体、压部形成,嘴部最晚形成,后有研究认为,嘴板(指胼胝体嘴部更靠下的部分)在胼胝体形成的最早期便存在,嘴部的背侧部分可能与胼胝体膝前部同时存在。
胼胝体发育不良是常见的闭合性颅脑畸形,包括胼胝体缺如或部分缺如。胎儿感染或缺血是胼胝体发育不良的重要原因。胚胎早期的宫内感染、缺血等原因可使大脑前部发育失常,致胼胝体缺失,晚期病变致胼胝体压部发育不良。
常首先累及体部和膝部,也可同时累及膝部和压部,但单独累及膝部的较少,仅见于前脑无裂畸形。胼胝体发育不良也有遗传基础。正常人胼胝体与脑组织前后径之比≥0.45,胼胝体发育不良者<0.3。
胼胝体发育不良可单独存在,亦可合并其他颅脑畸形,约50%的胼胝体发育不良可以合并其它先天性发育异常,如Aicard综合征、导水管狭窄、蛛网膜囊肿、脑萎缩、Chiair畸形、脂肪瘤、灰质异位、脑裂畸形、脑膨出及Dandy-Walker畸形等。文献报道,患者的临床症状与体征多由合并的畸形引起。
MR多方位成像比CT更能直观地显示颅内解剖结构,正中矢状位T1像是显示胼胝体的最佳方位,是胼胝体发育不全的最理想诊断手段,其MR表现有以下几个方面:
纵裂接近第三脑室前部(胚胎期纵裂与透明隔间腔相通,以后被胼胝体嘴封闭,若嘴不发育则纵裂与透明隔间腔相通,直达第三脑室前部。嘴部发育最晚,无论胼胝体发育不全或不发育均累及胼胝体嘴部。所以纵裂与第三室前部相通是最常见的表现。
胼胝体全部或部分缺如,部分缺如往往发生于胼胝体压部,海马、前或后连合缺如。
侧脑室前角向外移位,侧脑室内侧缘有凹陷的压迹。原因是原先连接两侧半球的前部胼胝体缺如,那些本来横向连接两侧半球的纤维现在呈纵向排列,位于侧脑室内缘,压迫侧脑室,形成压迹。畸形的两侧脑室前角彼此分离,形成蝙蝠翼状。
侧脑室体分离,相互平行,主要见于横断面图像上,可能是轻度胼胝体发育不全仅有的表现。
胼胝体压部缺如,使侧室三角区扩大。
大脑半球内侧面的脑沟呈放射状排列(在矢状面图像上)。
海马发育低下,导致侧室颞角扩大。深部白质发育不良也是侧室扩大的原因。
第三脑室位置升高,并呈囊状扩张,使两侧大脑内静脉分离。
在两侧半球之间的纵裂中形成大的囊肿,囊肿和第三脑室是分离的,与侧脑室之间可有或无交通。囊肿可以只位于大脑镰的一侧,或跨大脑镰,位于大脑镰两侧。
胼胝体膝部可合并脂肪瘤,脂肪瘤也可以延伸至胼胝体的所有部分。
鉴别诊断:
广泛缺血低血氧脑病,引起广泛脑白质疏松,同时可侵犯胼胝体,使半球纵裂增宽,很像胼胝体发育不良,二者鉴别有赖于临床病史;
大脑半球纵裂囊肿,位于中线,边界锐利,脑脊液信号,横轴位难与扩大上升第三脑室鉴别,冠状位显示囊肿位侧脑室上方,而扩大上升的第三脑室介于侧脑室之间。

反转征
儿童弥漫性脑白质和灰质的密度减低、伴有灰白质界限不清或消失,或灰白质密度反转,而丘脑、脑干和小脑密度相对增高根据“反转征”出现时间分急性和慢性2期。
急性指当时CT扫描即有“反转征”,慢性为弥漫性脑萎缩/脑软化伴“反转征”。急性期神经病理学改变主要为大脑皮质和白质发生急性神经元坏死和脑水肿,脑干及丘脑淤点状出血。
Baenziter等认为缺氧缺血后大脑皮层第Ⅲ、Ⅳ层神经细胞最易受损,缺血后12小时以上大脑皮层神经细胞即发生嗜酸样变性,基质发生凝固性坏死,2~3天轴索开始变性,7天左右出现成胶质细胞、脂肪颗粒和新生血管,2~4周形成空洞和软化,进一步论述了缺氧缺血后皮层神经细胞的病理过程。
基底节和丘脑损害所发生的密度增高目前有几种认识:
国内学者认为系缺氧后上述区域发生大理石样变性所致,表现为神经元的丧失、星形细胞胶样变性及髓鞘过度形成,尤其壳核背外侧与丘脑腹外侧髓鞘化最活跃,需氧量最高,代谢旺盛,对缺氧缺血敏感,因此受累也最为严重。
有的则认为是严重缺血后1~2周新生毛细血管网的大量增加或与大脑的白质深部髓质静脉扩张淤血有关,甚至有人认为不是密度增高,而是正常脑组织密度。
这种密度增高是相对的,虽然在急性期脑中央区域的密度增高个体间存在一定的密度差异,但本组从未见有像脑血管破裂出血那样的高密度,CT值多在22 HU左右,因此这种密度增高是相对的。
“反转征”的分期,急性期应以生后当时CT扫描结果为准。
一般来说,生后3天多以脑水肿为主,其后为脑实质缺氧缺血性损害,所以生后5~10天扫描较为可靠。慢性期以生后3~8周为妥,此期已出现明显脑软化、脑萎缩,脑实质密度明显低于急性期。
急性“反转征”的患儿需要呼吸支持和重症监护,延误治疗者可转变为慢性“反转征”,其密度变化更具有特征性。有人认为重症病人在3个月时即可发生脑软化和脑萎缩,发生率约占HIE病例的20%。
与此同时,丘脑与脑干的密度增高较急性期更加显著,如同“增强”一样,CT值22~26HU,丘脑形态轮廓勾画清楚,犹如雪山的“山丘”,出现这种明显反差的影像学表现可能与脑软化的低密度衬托有关,若不仔细的观察和测量CT值易误为脑出血。
“反转征”主要发生在重度HIE病例中,因此“反转征”可视为重度HIE少见而重要的征象,可把它作为HIE诊断及分级和评价预后的重要依据。
CT“反转征”是新生儿重度缺氧缺血性脑损伤的一种重要CT征象,但并非特异性,也可以在某些疾病中如外伤(虐待伤)、病毒性脑炎等出现。特别应注意慢性“反转征”与HIE的并发症鉴别。
众所周知,HIE常见并发症为外部性脑积水和局限性脑软化灶和脑萎缩,前者不存在鉴别问题,后者CT上脑软化灶多发生在顶枕叶或双侧脑室旁白质内,多为局限性,而慢性“反转征”则表现为半球弥漫性低密度区,同时基底节及丘脑等脑中央区域密度增高明显,表现特殊,这点对鉴别诊断有相当重要的价值。
因此,重度窒息儿大脑灰白质密度弥漫性减低伴灰白质界限消失或密度反转以及基底节、丘脑、脑干和小脑密度相对增高是重度HIE的特征性CT表现,是诊断急、慢性CT“反转征”的重要依据。
急性期脑室受压变窄和慢性期脑室扩大主要与脑水肿和脑软化/脑萎缩有关。“反转征”一旦出现,高度提示脑组织有不可逆性脑损伤存在,预后大多不良,即使存活也将发生脑瘫或智力障碍等后遗症。

小脑室征
指大脑组织弥漫性肿胀,密度减低,脑沟消失,侧脑室变小。大脑血-脑脊液屏障破坏。血管内液体渗人到细胞外间隙,脑间质内含水量增多。颅内压增高,侧脑室受压变小。
颅脑损伤在外伤患者中较为常见,可导致头皮挫伤或裂伤、颅骨骨折及颅内损伤,后者根据病情进展及发病机制又分为原发性颅内损伤和继发性颅内损伤。
原发性颅内损伤可进一步分为轴外病变和轴内病变,前者包括急性硬脑膜外血肿和急性硬脑膜下血肿,后者包括脑挫伤、弥漫性轴索损伤和颅内出血,为外伤直接冲击所致,病变为不可逆性。
继发性颅内损伤包括弥漫性脑肿胀、脑痛、继发性出血或梗死、缺氧性脑损伤及感染。为外伤数小时或数天后形成。
小脑室征为因间质水分增加而形成的脑水肿所致。颅脑外伤性脑水肿为血管源性水肿,由于大脑血-脑脊液屏障破坏,血管内富含蛋自质的液体渗人到细胞外间隙,脑间质含水量明显增多,以自由水增多为主。结合水增加为辅。
有些患者在发病数小时或数天内,脑血容量增加,形成脑充血,是形成弥漫性脑肿胀的另一个重要原因,其病理改变为血钾代偿性扩张,脑组织无破坏。
若脑水肿和脑充血两种病理改变同时存在,颅内压增高更加显著,侧脑室受压吏加明显,侧脑室体部可呈细小的窄带状。大体标本观察双侧大脑华球增大,脑沟消失,有时可形成小脑幕。
CT为无创性检查方法,在颅脑外伤患者中应用广泛,尤其在急性期应用价值更高。
由于脑组织含水量增加异致其较止常脑组织CT值下降,CT值的下降值与脑组织含水量增加的程度成正比,组织水含量每增加1%,CTA值可下降2~3HU。
CT图像显示大脑组织弥漫性肿胀,密度降低,灰自质界面分辨不清,侧脑室体部变小。三角区、后角及卜角亦明显缩小,脑沟消失,侧裂池变窄,基底池变小,尤以环池明显,小脑密度相对增高(白小脑征)。
病情严重者可形成双侧小脑幕疝。充血脑组织由于含血量增加,脑组织的密度井不行降反而升高,CT值较正常脑组织增加。
MRI对显示病变的病理过程敏感且精确,但由于其检查时间较长,病情严重者不易进行此项检查。
躁动患者可在检查前使用药物以使患者保持安静,以协助完成检查。另外,头部有金属异物的患者不能做MRI检查。因此,MRI在急性外伤患者的应用受到一定限制。
脑水肿为颅脑外伤的常见并发症,可单独出现,但常合并其他类型颅内损伤。由于急性脑肿胀脑组织含量水增多,占位效应明显并导致颅内压增高,有时局部脑组织可形成缺血性脑梗死,若合并硬脑膜外(或下)出血,颅内压增加更加明显。可形成双侧小脑幕庙,其预后较差,并有致命的危险。
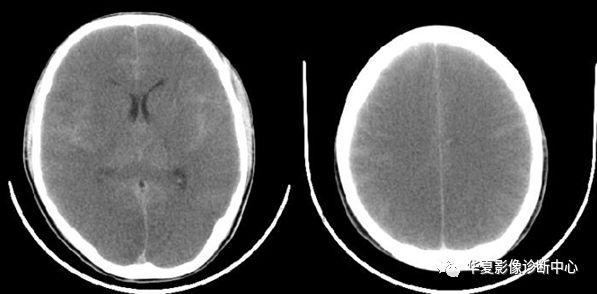
磨牙征
是由于Joubert综合征患者的小脑上脚纤维束缺乏正常交叉,导致小脑上脚垂直地行走于中脑和小脑间的脑干中,致小脑上脚增宽,而且显得更为平行;小脑上脚的纤维缺乏交叉使中脑前后径缩短,尤其是中线区域,导致脚间池较正常更深。
在CT和MRI横断面上增宽的中脑、凹陷加深的脚间池和平行状走行的小脑上脚在其周围脑脊液的衬托下,中脑和小脑上脚形态犹如磨牙的侧面观,被称为“磨牙征”。
Joubert综合征是一种较为罕见的疾病。目前,本病被认为是一种常染色体隐形遗传病,可能是因后颅窝纤维束不能交叉到中线而导致的一系列病变。
其病理特征为小脑蚓部发育不全或不发育而形成异常的“中线裂”,伴小脑齿状核变形、下橄榄核和旁橄榄核发育不良、背侧柱核异常和椎体交叉的几乎完全缺如,部分存在小脑上交叉及桥脑中央束的缺如。
患者很小时即可出现临床症状,主要表现为肌张力减低、共济失调、运动及智力发育落后、呼吸异常以及眼球运动异常。患者的临床表现不尽相同,预后通常较差。
Joubert综合征应与Dandy-Walker畸形、Down综合征、大枕大池、蛛网膜囊肿及PEHO综合征等相鉴别。
尽管Dandy-Walker畸形也可伴有小脑蚓部缺如,但其典型的表现是第四脑室向上方扩张及颅后窝扩大。
Joubert综合征与Down综合征仅凭影像学鉴别有困难,根据临床表现或染色体组型可明确诊断。
大枕大池亦显示颅后窝低密度区,但其小脑蚓部完整。
蛛网膜囊肿则位于脑外,多为局限性脑池扩大,有占位效应,可引起梗阻性脑积水。
PEHO综合征有脑干、小脑蚓部发育不良,髓鞘形成异常,视神经萎缩,临床上多有皮下非凹陷性水肿,但从影像上很难与Joubert综合征相鉴别,须依靠临床症状才能明确鉴别。
当见到小脑半球间“中线裂”、中脑“磨牙征”和第四脑室“蝙蝠翼”征等征象可提示Joubert综合征,须密切结合临床才能作出诊断。
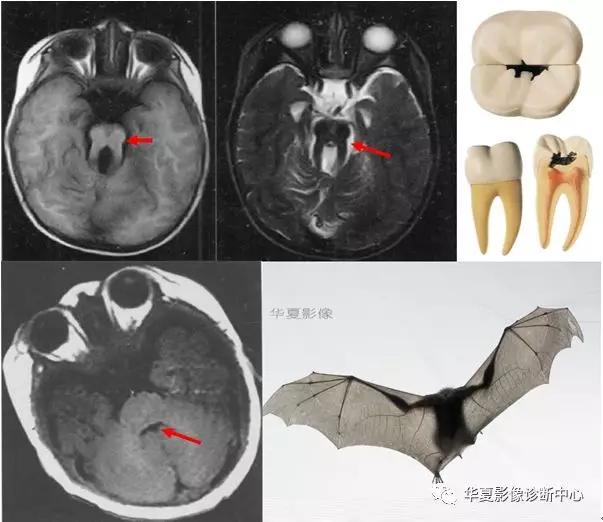
十字征
即MRI的T2加权像上脑桥的十字形异常高信号影,见于橄榄桥小脑萎缩(OPCA)患者,在多系统萎缩(MSA)其他亚型也可出现。由于MSA临床表现复杂,很难做出早期诊断。
因此,“十字征”对MSA的诊断及分型具有重要作用。表现为不同程度的帕金森综合征、小脑性共济失调和自主神经功能障碍的重叠组合。根据受累部位的先后及临床表现的不同,可以分为不同的临床亚型。
其病理主要是小脑、桥脑、下橄榄核萎缩,神经细胞脱失伴胶质增生。脊髓后索、橄榄脊髓束、皮质脊髓束以及脊髓小脑束变性,克拉克柱细胞及前角细胞脱失,亦可累及红核、黑质、基底节及大脑皮质。
临床上可有小脑、自主神经、锥体外系、锥体束等多系统受累的临床症状和体征。有研究资料表明,无论以锥体外系或小脑受累为主要临床表现,自主神经受累总是在此之前或与之同时出现。
但是临床实践也发现MSA患者即使影像学表现正常,亦不能排除纹状体黑质病变可能,有关文献报道,单光子发射型计算机体层摄影(SPECT)结合MRI有助于提高MSA。
MSA分型中以OPCA患者的头部MRI表现“十字征”居多,OPCA典型的幕下形态学改变是橄榄、桥脑腹侧及小脑中脚和小脑萎缩:
橄榄萎缩导致延髓腹侧上部变平,延髓桥脑沟变浅。
桥脑萎缩最为常见。以桥脑腹侧改变为著,被盖部改变不明显。
小脑中脚常有萎缩,这是桥脑-小脑束易被累及的影像学体现。
小脑萎缩以小脑半球,特别是其前部改变较为明显。小脑和脑干萎缩往往继发四脑室和邻近脑池扩大,而脑池改变以桥前池增宽最为常见,桥小脑脚池、小脑延髓池增宽次之。
国外有学者把“十字征”的演变过程分为6期:
0期为正常;
Ⅰ期为脑桥开始出现垂直的高信号影;
Ⅱ期为出现清晰的垂直高信号影;
Ⅲ期为继垂直线后开始出现水平高信号影;
Ⅳ期为清晰的垂直线和水平线同时出现;
Ⅴ期为水平线前方的脑桥腹侧出现高信号,或脑桥基底部萎缩引起的腹侧脑桥体积缩小,并发现水平线总是无一例外地继垂直线后出现。
发现所有的OPCA患者在起病的2~3年内出现垂直的高信号影(达Ⅰ期),71%患者在5年内出现“十字征”(达Ⅳ期),7年内均达Ⅴ期。而且随着时间变迁在桥脑轴位T2WI上出现典型的“十字征”。
国外学者认为“十字征”机制是脑桥核及桥横纤维变性。胶质增生致含水量增加,而由齿状核发出构成小脑上脚的纤维和锥体束未受损害,从而形成MRI上T2加权像上脑桥的十字形高信号影。
有文献报道在MSA的三种临床亚型中均有类似征象。就本病而言,其临床症状的进展与影像学的变化相吻合,很好地展示了此病的演变与加重的过程。

水母头征
在血管造影、增强CT或MRI上,脑实质内多支明显强化的小血管呈伞状或放射状汇聚成一支粗大的血管。形似水母头,称为“水母头征”或“海蛇头征”。
本征象是脑发育性静脉异常(DVA)在MR上的特征性表现。现在多数学者认为DVA并非血管发育畸形,而是一些极度的解剖变异或静脉发育异常。
多数作者认为其是在脑的胚胎发育过程中,脑的动脉系统即将发育完成时,由于宫内意外因素,导致静脉回路阻塞,致胚胎髓静脉代偿性扩张,扩张的深髓静脉被大的穿支静脉引流至邻近表浅静脉窦或室管膜下静脉而形成。
组织学上由很多细小的深髓静脉和一至两条扩张 的引流静脉组成。仅含有静脉成分,没有动脉,扩张的髓静脉间为正常的脑组织。
发育性静脉异常又称静脉瘤,是脑血管畸形的一种类型。该病多无症状,部分患者可出现癫痫、感觉障碍、共济失调等症状。发育性静脉异常是由一群不规则的静脉组成,包括深部的髓质静脉和浅部的引流静脉,分布于正常脑实质中,其内可见正常的脑组织。
DVA的发病部位多位大脑深部及小脑白质,最常见的部位是侧脑室前脚四周,其次是小脑和纹状体区。
典型的MR表现就是多数扩张的髓质静脉呈辐射状排列,合并汇入一支或几支明显增粗的引流静脉,其外形非常类似水母,故称“水母征”。该病一般无占位征象及水肿表现。

铠甲征
MRI增强后,大脑半球凸面硬脑膜,大脑镰及小脑幕弥漫性均匀性对称性强化,且广泛包绕脑组织形成“铠甲”样外观,称为“铠甲征”。
铠甲征多见于自发性低颅压综合征(SIH),这是一组由多种原因引起,以体位性头痛为典型临床表现的一组综合征,其侧卧位腰穿CSF压力<60mmH2O。
MRI是诊断SIH的重要方法。SIH患者头颅MRI常见的表现为:
硬膜下积液或出血,厚度<1.0cm,占位效应不明显;
硬脑膜静脉窦扩张;
脑结构移位,脑下沉;
硬脑膜弥漫性增强,系SIH早期、特征性MRI改变。
MRM常表现为在蛛网膜下腔CSF正常走行以外的团状、线状高信号影,这些高信号影与蛛网膜下腔相连,提示存在CSF漏。
硬膜下积液被认为是颅内液体腔隙对CSF压力减低的一种代偿性反应。约 10%的患者出现硬膜下血肿。
SIH时CSF总量减少,由于脑组织容积相对恒定,因此颅内血容量代偿性增加,以硬脑膜和静脉窦为主的静脉系统明显扩张,同时由于脑组织移位,牵拉硬膜与蛛网膜之间的桥静脉或静脉窦使之破裂出血而引起继发蛛网膜下腔或硬膜下出血等表现。
另外,低颅压经快速大量输液后易致已扩张渗血的静脉进一步破裂出血。窦汇扩张后下缘向外凸呈弧形改变。
有报道此征象对低颅压综合征的特异性达94% ,此系由于硬脑膜静脉窦位于血-脑屏障之外,缺乏紧密的连接而产生代偿性扩张,毛细血管通透性增高,对比剂在硬脑膜微血管及间隙聚集。
低颅压时易发生脑干结构移位,统称为“下沉脑”,影像学表现为部分病例双侧脑室缩小甚至呈缝隙状、基底池模糊、外侧裂变窄。鞍上池消失,视交叉下移,垂体受压。脑桥、间脑腹侧压向斜坡致桥前池狭窄或闭塞。中脑导水管开口位置下移。SIH患者约62%出现小脑扁桃体下疝,一般为轻度。
硬膜下积液、硬膜下血肿及脑结构移位,则预示存在较严重的SIH。SIH致垂体增大可能是由于垂体周围组织为代偿CSF压降低而充血所致。这种表现可能会导致误诊断为垂体腺瘤或其他肿瘤。
SIH并发静脉窦血栓通常是继发于腰穿、硬膜外麻醉、鞘内注射药物等,其主要发生机制可能与CSF的有效容量降低使静脉瘀滞后再扩张而触发静脉窦血栓形成。
SIH好发于中年女性,多为急性或亚急性起病。平均年龄为41.9岁。SIH主要应与肥厚性硬脑膜炎、脑膜癌病、化脓性、结核性脑膜炎等相鉴别。
总之,SIH的影像学特点为脑下沉及硬脑膜对称并均匀一致性增厚、增强,且形成包绕脑组织的“铠甲”样外观。

空三角征
在CT或MRI增强图像上,在多个连续的横断CT或MRI图像上表现为上矢状窦三角形增强或高密度区域内出现相对低密度区。
空三角征为矢状窦血栓形成时颅脑增强CT或MRI的常见征象,出现率约为35%,表现为强化的三角形环即中心低信号周边为三角形高信号,位于上矢状窦区。矢状窦邻近有血管丛,为血栓形成后的侧支循环。
目前对该征病理生理的解释并不一致,包括以下假说:
静脉窦内血栓再通。
栓子机化。
血脑屏障破坏
硬膜外和硬膜侧支静脉的扩张。
有认为最合理的解释为硬膜血管的强化,为所在区域的血管网(硬膜海绵间隙)和脑膜静脉属支的强化,中心低密度为栓子。
国外学者认为血栓形成的主要原因有3个:
血管易于血栓形成,包括原发性和遗传性疾病。最常见为继发性凝血酶原激活如妊娠,血液或系统性疾病如红细胞增生症、系统性红斑狼疮、恶性肿瘤、脱水导致血液浓缩,药物如避孕药或化疗药如L-天门冬酸胺酶。
血流障碍如肿瘤、心衰、动静脉痊。
静脉窦壁的炎症、感染、纤维化或损伤,如静脉窦炎、外耳炎、乳腺炎和创伤。
1/4的病人查不到原因。矢状窦血栓形成的临床表现有头痛、视乳头水肿等。急性脑静脉窦血栓形成往往存在比较典型的表现,可见上矢状窦区三角形以及横窦区条索状高密度影,是脑静脉窦内新形成血栓病变早期的直接反映;
临床上虽然脑硬膜窦血栓的发病率较高,不过单纯大脑浅静脉及深静脉部位的血栓形成较少;
CT增强显示空三角征或条状充盈缺损,特征明显,对急性和亚急性患者有重要意义。
CT平扫亦可显示由于静脉淤血、静脉性脑梗死以及脑脊液重吸收障碍引起的病理征象,如对称或弥漫性脑肿胀、多灶性脑出血等。
MRI平扫对本病较为敏感,可显示不同时期血栓的信号,而正常静脉窦的留空信号则消失。
急性期T1WI为等信号,与留空信号较为接近,T2WI为低信号,由于信号特征较不明显,因此MRI不易诊断;亚急性期T1WI、T2WI均为明显高信号,容易确诊;慢性期各脉冲序列血栓信号减低,常常出现假阳性。但是可通过与CVST引发的脑水肿、脑梗死、脑积水等间接征象相结合,以辅助诊断。


室管膜点线征
指在MRI矢状位FLAIR序列中胼胝体下表而点状不规则高信号,中间由划线状低信号相连接。胼胝体下缘点线征中的“点”为异常增厚的室管膜,而“线”为正常的室管膜,推测与水通道蛋白有关或其他原因所致。对于点线征中的“点”随着时间的增加,或演变为胼-隔界面征。
此外,研究还发现点线征主要位于胼胝体的嘴部、膝部及体部,而压部没有发现有点线征,分析胼胝体下缘点线征的部位的选择性可能和水通道蛋白的分布有关。此征象尤其对视神经脊髓型MS(OSMS)患者脑部胼胝体下缘点线征更有临床诊断意义。
多发性硬化(MS)是中枢神经系统常见的致残性炎性脱髓鞘疾病,常可累及视神经、脊髓及脑,其病因目前并不明确,可能与遗传、环境因素、病毒感染及自身免疫有关。
西方国家的人群病变常累及幕上幕下,具有时间和空间上的多发性。而对于亚洲人群,首发症状通常为视神经或脊髓受累症状,而脑内病变并不具有特异性。
FLAIR序列可以更好地显示脑室旁及脑实质与脑脊液交界处病变,矢状位T2-FLAIR图像可以较质子密度图像及自旋回波图像更好地发现MS病变。
胼胝体是连接大脑半球的白质纤维束,是MS常累及的一个部位,矢状位薄层扫描是观察胼胝体病变的最佳平面。
研究发现,胼胝体下缘点线征是MS的早期MRI表现,其敏感性及特异性均优于其他MS早期征象,可以为MS的早期诊断提供一定的帮助。

子母环征或多房征(套环征)
CT或MRI增强扫描,多房脑脓肿的壁明显强化,呈多个圆形或卵圆形相互连接的环,环的大小相同或不同,相邻环的夹角——锐角。
脑脓肿包膜期,病变周围形成肉芽组织;若包裹不完全则可在病灶旁形成子病灶,子灶化脓形成子脓肿。
根据病理组织学特点脑脓肿可分为四期,即早期脑炎(1~3d)、晚期脑炎(4~9d)、早期包膜形成期(10~15d)、晚期包膜形成期(14d以上)。
有文献指出脑脓肿的CT表现依各阶段的病理改变有相应变化:
早期脑炎,CT示境界不分明的不规则低密度影,占位效应不明显,此时反映了病理上的炎细胞浸润,脑组织肿胀及坏死,少数病例可有斑点状高密度出血灶。
晚期脑炎,CT示病灶仍为低密度影,脑水肿较前明显。增强示斑片状、结节状及环形强化,邻近脑组织可见脑回状强化。此期的增强环影内外像模糊,强化边缘向中心扩散,环壁随时间延长而增厚,最终呈结节样强化。此期的时间密度曲线为扁平型,强化机理为炎症区血脑屏障功能破坏所致。
早期包膜形成期,CT示脓肿中央呈低密度。
晚期包膜形成期,CT示包膜增厚,约3~6mm。增强示环壁更加光滑完整,延迟扫描环壁逐渐增厚,中央不强化,此期时间密度曲线为陡直型,其强化机理为炎症区血脑屏障破坏和新生血管共同作用的结果,部分脓肿壁厚薄不均,近皮质部厚,脑深部薄,考虑与脑皮质血供丰富有关。
包膜期脑脓肿MRI增强扫描也有其特征性。强化环的外径略大于低信号“暗带”的外径,说明了强化环的形成主要与脓肿壁第4带的新生血管有关,而强化环外侧淡薄的云絮状强化为炎症区血脑屏障破坏所致,这种强化反映了脑脓肿炎性病变的特征。
有文献报道小脓肿多呈不规则低密度影,占位效应较轻,增强多呈结节强化,强化灶多偏一侧。
多房性增强可见多个相连的环为典型特征,亦称“子环征”。MRI扫描,均呈不规则长T1、长T2信号,其中有些病灶内见环形或点状脓肿壁呈等T1、短T2信号,与CT显示的脓肿壁相符。
由于MRI对正常及异常水分布敏感,故对早期脑炎的脑细胞水肿较CT显示清楚。少部分首次CT正常的脓肿,而MRI却显示出病灶。
MRI T1W1显示坏死脑组织的低信号区大于CT所示的低密度区,与术中所见病理坏死区一致,能更准确提示病变的程度。顺磁造影准确定性诊断。
多发脓肿要注意与多发转移瘤鉴别:脓肿可见“子环征”,转移瘤以小结节大小肿为主要特征,且有原发灶。

蜂鸟征
在进行性核上性麻痹(PSP)患者的磁共振成像正中矢状位上的影像表现。PSP以中脑被盖的萎缩为主要特征,萎缩的中脑被盖喙在MRI矢状位形似蜂鸟的嘴。因而称为“蜂鸟征”。
PSP患者在MRI正中矢状位可以显示蜂鸟征,蜂鸟征形成的病理基础主要是中脑被盖(包括喙和尾)的萎缩和中脑被盖前后径缩小引起的脚间窝长度的相对增加,因此蜂鸟征的出现可以反应中脑被盖的萎缩,强烈提示PSP患者正中纵行纤维束喙间核受累,有助于PST的诊断。
PSP是一种发生于中老年人的中枢神经系统变性疾病,临床表现为轴性强直,垂直性眼球运动障碍,早期出现反复向后跌倒。
但临床诊断为很可能PSP患者,经病理诊断证实的阳性预测率约80%~90%。其临床病理特征为:中脑顶盖和被盖萎缩、黑质色素脱失,第三、四脑室及导水管轻度扩张。
国外学者发现PSP的中脑顶端萎缩,认为这种萎缩看上去像“蜂鸟的嘴”,故将这种影像学结构称之为“蜂鸟征”,也就是中脑上缘的平坦或凹陷表现,反映PSP以中脑为主的特征性萎缩。
有观察者研究PSP与帕金森氏病(PD)在正中矢状面MRI上中脑平坦或凹陷,对于二者的鉴别,结果提示在PSP与PD的鉴别诊断中具有68%的敏感性和89%的特异性如下图(黄箭头显示蜂鸟头部形态的不同)。
“蜂鸟征”具有100%的敏感性和87%的特异性。在T1加权像矢状位检测中脑被盖和桥脑被盖的断面面积以及中脑与桥脑的面积比,是鉴别PSP与其他帕金森综合征的另一个重要参考指标。
在PSP中脑被盖断面面积明显降低,接近PD患者的54%;中脑/桥脑断面面积比值低于PD。中脑与桥脑断面面积的比值PSP明显低于PD。有学者研究发现,中脑断面面积的改变与中脑上缘萎缩的表现一致。
因此一般认为观察中脑上缘平坦或凹陷以及测量中脑断面面积的改变,可以作为PSP影像学诊断的形态学标志。
有报道指出,在轴位T2加权像PSP平均中脑前后径明显减低,平均中脑前后径在PSP为(13.5±1.4)mm,PD为(15.5±1.6)mm,两者具有显著性差异;但也提示两者之间中脑前后径大小虽然存在差异,但是也存在明确的重叠现象。
中脑前后径大于13mm在PSP与PD重叠表达。在PSP的病理研究中发现,中脑红核和黑质等皮质下结构神经元脱失比较严重,可以认为红核和黑质的萎缩是导致中脑前后径减低的因素,因其受累的程度不同,使中脑前后径减低会有不同的表现。
在PSP患者中,脑组织病理可见神经元严重缺失、胶质细胞增生、神经纤维缠结以及tau蛋白在神经元和胶质细胞异常聚集。
上述表现在中脑主要见于中脑导水管周围灰质、Edinger-Westphal核、顶盖前区、楔状核等区域,这些区域的变性、神经细胞丧失及胶质增生可以导致PSP患者导水管腹侧T2加权像出现弥散性高信号。
比较PSP和PD轴位T2加权像上中脑导水管腹侧的高信号,提示出现高信号的敏感性和特异性分别为28%和100%。PSP患者中脑导水管腹侧的高信号具有较高的特异性,但是敏感性较低,所以很少用在PSP与其他帕金森综合征的鉴别诊断中。
PSP患者中脑前后径变小,导水管扩张,四叠体池增大,在冠状位中脑看似“鼠耳”,国外学者将这种表现称为“鼠耳征”。
PSP在中脑形态学的改变可以通过MRI检查的方法进行分析和判断,并成为PSP诊断和与PD相鉴别的重要依据。
中脑上缘的平坦或凹陷表现具有较高的特异性,同时中脑被盖断面面积的减低以及中脑/桥脑断面面积的比值是鉴别PSP与其他帕金森综合征的另一个重要参考指标。
平均中脑前后径在PSP与PD存在差异,但也存在明确的重叠现象。中脑导水管腹侧的高信号具有较低的敏感性,不能成为评估PSP的可靠指标。中脑萎缩的程度不能作为判断PSP中脑顶端萎缩轻重的指标。

铁环征
由于反复多次少量慢性出血,多数颅内多数海绵状血管瘤周边可出现低信号环,有人将这种病灶周围低信号包绕形态称为“铁环征”,这是由于含铁血黄素沉着、单核细胞浸润和胶质增生等所致。多数病灶无明显占位效应。
MRI对脑海绵状血管瘤的诊断敏感性较CT高且具特异性,信号特征与其病理有关。T1WI像可呈低等混杂或略低信号,T2WI像呈高信号或混杂信号,表现为典型的“玉米花”样改变。
脑海绵状血管瘤的信号随不同阶段的出血而表现不同,当脑海绵状血管瘤急性出血时,在T1WI上为等信号,在T2WI上为高信号;伴亚急性出血时,在T1WI、T2WI上均为高信号;
由于反复多次少量慢性出血,多数脑海绵状血管瘤周边可出现环形低信号环,为含铁血黄素沉着、单核细胞浸润和胶质增生等所致,这是脑海绵状血管瘤的MRI特征性表现。其两大特征是:
瘤灶中心的血栓和反复出血,内含游离稀释的正铁血红蛋白,在所有成像序列中均呈高信号;
血栓与出血灶外周形成的含铁血黄素环在所有成像序列上都是黑色低信号,且T2WI像上最明显。
有学者将其表现分为四型:
I型,T1WI病灶核心呈高信号(含正铁血红蛋白),T2WI开始呈高信号,随后逐渐变低,病灶周围出现低信号圈,病理上相当于亚急性出血,由血肿边缘开始,正铁血红蛋白很快降解为含铁血黄素和铁蛋白;
II型,T1WI病灶核心呈网状混杂信号,T2WI在网状混杂信号周围尚有一低信号圈,病理上相当于机化不一的血栓和小血肿;
III型,T1WI呈等信号或低信号,T2WI明显高信号,病理上相当于慢性出血、血肿溶解后残留的含铁血黄素;
IV型,T1WI与T2WI难以显示,梯度回拨序列成像呈许多针头大小的低或中等信号影像。尤其是梯度回波序列成像己被认为是诊断家族性脑海绵状血管瘤的“金标准”。
尽管脑海绵状血管瘤临床表现复杂,起病形式多样,但MRI有一定特征:
病灶中的T1Wl显示低信号或等混杂信号,如有出血以高信号为主的混杂信号;
T2WI可见病灶周围含铁血黄素沉积,而出现“铁环征”;
病灶周围常无或轻度脑组织水肿及占位效应不明;
多数病灶不增强或轻微强化;
高强场的MRI对脑海绵状血管瘤有较高的诊断特异性和敏感性。低信号环绕的桑甚状混杂信号团是脑内型海绵状血管瘤诊断的特异信号。
另外有一种称作囊性海绵状血管瘤的病变,为一种很少见的良性病变。
多位于颅后凹(小脑半球或第四脑室底),也可见于幕上(丘脑,枕叶)及硬膜窦内。可为单发或多发。以中青年居多,性别差异不显著。MRI示囊性占位,囊肿壁可有单个或多个实质肿块。囊肿壁与肿块均可强化。
脑海绵状血管瘤主要与脑内肿瘤出血、高血压脑干出血相鉴别。
肿瘤出血,常有肿瘤周围血肿及明显的占位效应,出血肿瘤周围多无含铁血黄素沉着所形成的低信号环,增强后,可见肿瘤组织呈不规则团块状或环状强化,可资鉴别。
高血压脑出血与脑海绵状血管瘤急性出血CT上表现相似,在MRI的T2WI上,脑海绵状血管瘤急性出血灶周边见含铁血黄素沉着所形成的低信号环,此特征表现可以鉴别。

蝴蝶征
CT上两侧侧脑室三角区周围脑白质内呈对称性、大片状密度减低区;MRI上长T1长T2信号,两侧病灶通过胼胝体压部相连,呈“蝶翼状”分布。是儿童型肾上腺脑白质营养不良的典型CT或MRI征象。
肾上腺脑白质营养不良(ALD)又名肾上腺-弥漫性轴周性脑炎,是一种性染色体连锁隐性遗传性全身脂质代谢异常性疾病。好发于3~14岁的男孩,多数病人年龄为9岁左右。
临床表现以进行性脑功能障碍合并肾上腺皮质功能不全为特点。脑与肾上腺皮质受损症状可分别出现,并以前者症状为突出。多以脑功能障碍症就诊,随着病程的延长,症状进行性加重。个别可出现全身皮肤变黑,口唇青紫,患儿同时伴有显著的智力障碍。
本病的致病原因为患者缺乏击断长链脂肪酸的一种酶,使该长链脂肪酸在组织中,尤其在脑、肾上腺皮质内沉积,致使脑白质破坏,肾上腺皮质被摧毁。研究显示,该病经测试血浆长链脂肪酸含量,其结果多有明显增高。
颅脑CT表现:
ALD的一个显著特点是病灶由后向前逐渐发展。病变通常起自双侧顶枕区的双侧脑室周围,继而向颞,额叶发展,最后累及半卵圆中心的大部分,可累及胼胝体,但不侵犯皮层下弓形纤维。
ALD的CT表现具有特征性,其典型表现为双侧脑室三角区周围对称分布的低密度区,呈蝶形分布,部分病灶内可见细小集簇状钙化影,主要位于双侧顶叶深部的白质区,对称分布,CT上顶枕区集簇状钙化的显示是本病的一个特征。增强扫描病灶边缘可见花边状或带状强化,一般均无占位效应。
MRI表现:
双侧脑室三角区周围对称分布的蝴蝶状异常信号影,在T1WI呈低信号,在T2WI呈明显高信号,受累的胼胝体压部将两侧蝶翼状的病灶连成一片。
随着病程的进展,脱髓鞘病灶由后向前扩散,由顶叶白质区逐渐向前累及颞叶、基底节区及额叶,并向下扩延累及脑干。
病变前部T1WI信号高于后部的信号,在T2WI上低于后者的信号。
晚期病灶范围广泛,呈长T1长T2信号,增强后无强化,并有脑萎缩表现,小钙化灶在MR上不易显示。冠状面T2WI上除可见清晰显示脑室周围及胼胝体压部的病变外,尚可见特征性的表现——华勒氏变性,即沿锥体束行程分布的倒八字形的长T2信号。

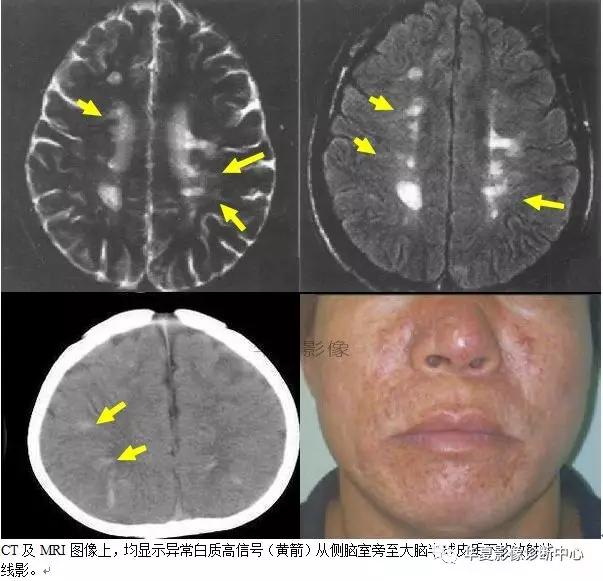
日光带征
影像上表现为直线或曲线状异常信号呈放射状从侧脑室周围至大脑半球皮质下区域。
日光带征可见于结节性硬化的患者,代表发育不良的干细胞沿着放射状走行的神经胶质单元的异常迁移,这种表现也被称为迁移束或线状异常。
放射状异常的自质信号代表多种神经分化、星形细胞分化和不容易分类的簇状排列的巨细胞。相同的巨细胞可用不同的组织学技术进行分类。这提示结节性硬化可能是由于发育障碍所致。它发生于发育的早期并导致细胞移行或不完全星形细胞性或神经元性分化。
结节性硬化症(TSC)为神经皮肤综合征的一种,是由于细胞分化和增殖异常伴有神经元移行障碍的一种疾病。病变不仅累及外胚层起源的器官如神经系统、皮肤和眼,还累及中胚层的器官如心、肺、骨、肾和胃肠等。临床特点为多系统、多器官受累。
本病的发病率约1/10万~3/10万,患病率5/10万,男女比例约为2:1,多在儿童及少年期发病。本病为常染色体显性遗传病,有报道认为,44%或更高比例的患儿有家族史。
患者在CT上多可发现室管膜下钙化结节,一般推测结节及其钙化在生命早期即已形成。文献报道约50%的病例在10岁时出现钙化。钙化的皮质结节呈高密度,形态可不规则。未钙化结节呈等密度时不易显示,当伴有脱髓鞘改变时,结节周围出现低密度区,可比衬出轮廓。
CT上皮质结节的表现,有关文献总结出有3种:
脑回空心样病灶,表现为病变脑回呈膨胀性改变,其中心为低密度,周边是等皮质密度围绕,似面包圈样;
“H”型病灶,表现为“H”型病灶中的横道上、下区域为低密度,余为等皮质密度;
高密度团块状病灶。
病理研究表明皮质结节灶内可见胶质细胞及胶质纤维大量增生,神经细胞相对减少,并可见单个或成堆的巨大星形细胞,这些细胞中某些有钙化并可见浆中空泡形成,因此在显示钙化结节方面,CT是最理想的方法。
脑结节性硬化MRI脑白质异常表现为:
放射状线状T2WI及FLAIR高信号灶,从脑室或近脑室白质延伸至正常皮层或皮层下结节;
楔形T2WI及FLAIR高信号灶,尖端位于或邻近脑室壁而基底位于皮层或皮层结节;
不定形或肿胀T2WI及FLAIR高信号病灶。
病理上表现为纤维胶质增生或(和)髓鞘破坏,近期的研究认为是神经元移行障碍的结果。
结节的部位,位于脑室系统室管膜下,部分可突入脑室形成腊滴样改变;部分患者因结节阻塞脑脊液回流径路引起脑积水及脑室扩大;部分患者可见皮层及皮层下钙化结节。
文献报道,皮层和皮层下结节,CT也可对其存在和位置做出一定提示。皮层灰质结节的CT表现与年龄有关,新生儿期表现为增厚的皮层灰质内高密度影,随年龄的增长与灰质等密度,并发生部分或全部钙化。
成人室管膜下和皮质内结节在T1加权像上为等信号,T2加权像上为高信号;钙化结节在各加权像上均为低信号,如为不完全钙化,在T2加权像上可见钙化部分呈低信号,未钙化部分呈高信号。如钙化灶位于结节中心,则周围未钙化部分呈环状高信号,增强后5%的皮层灰质结节可见强化。
新生儿期因脑白质髓鞘形成不完全,皮层灰质结节在T1WI信号略高于脑白质,T2WI低于脑白质。
根据位置不同,MR上皮层结节被分为PellizziⅠ型和PellizziⅡ型,即脑回核、脑沟岛型。
脑回核指结节病灶占据脑回内部核心,脑回呈膨胀性改变、表面光滑;脑沟岛指病灶位于两个脑回之间连接处,脑回表面中心塌陷。
FLAIR比T2WI能够更加敏感地发现颅内皮层及皮层下非钙化结节病灶。分析FLAIR病灶检出率高有两个原因,一是克服了脑脊液的干扰,二是增强了对病灶的显示。
即FLAIR序列抑制了脑脊液信号,从而可避免脑脊液的部分容积效应及流动性伪影的干扰,使位于脑室内、脑室旁及灰质区的小病灶得以显示;同时延长TE产生重T2加权像,突出长T2成分,形成病变与背景的高对比,更清楚地显示病变,提高了对对颅内结节诊断的灵敏度。
以往文献报道,颅内结节多发生于额叶,其机制不清。此外,结节性硬化患者还可能出现颅内巨细胞星形细胞瘤。
白靶黑靶征
脑猪囊尾蚴病在CT平扫大多表现为小园形囊性病灶,大小为4~6mm,CT上为类圆形低密度内可见点状高密度,即所谓黑靶征。
或在MRI上呈长T1长T2信号,部分病灶在T1WI上黑色的低信号内见到点状高信号,即黑靶征;在T2WI白色高信号内见到点状低信号,即白靶征。
脑囊尾蚴病,脑实质囊虫CT显示多发的圆形或卵圆形大小不一(0.1~0.5cm)的结节状高密度影及(或)多个类圆形低度密度灶,边缘可见小点状高密度影,直径0.5~1.5cm,部分病例病灶显示不清楚,仅见大片低密度区,类似脑炎改变。少数病例可见大囊型病灶,直径达7~8cm,多为单发或仅有几个病灶。
脑室内囊虫为圆形囊状,直径为1~4cm,边缘光滑,稍低于脑脊液密度,或近似脑脊液密度。脑池、颅底部蛛网膜下腔囊虫呈葡萄状低密度病灶,囊壁有浅淡强化。可有脑积水表现。
脑囊尾蚴MR表现:
多发小囊型,系多个存活期囊尾蚴并存的表现。MR表现为双侧大脑皮质区有多个散在分布的小圆形或卵圆形小囊,直径0.3~0.8 cm,呈长T1WI、长T2WI信号,壁内可见偏心型小点状影,即囊虫头节,呈短T1WI、稍短T2WI信号改变,周围水肿不明显。Gd-DTPA增强扫描,囊壁呈环状强化,头节呈点状强化。
大囊型,系一个巨大囊尾蚴或多个囊尾蚴融合而成的表现。MR表现为脑实质内巨大的圆形或卵圆形囊腔,其内无头节,信号与脑脊液一致,呈长T1WI、长T2WI信号,周围可合并脑水肿,有占位效应。Gd-DTPA增强扫描,大囊本身多无强化,若周围有纤维组织增生,可呈环状强化。
脑室内囊虫亦引起脑积水,MRI表现为囊虫所在部位脑室呈不对称性增大,呈长T1WI、长T2WI信号,存活期囊虫多较脑实质型虫体体积大,直径可>2 cm,囊壁上可见偏心型头节影呈稍短T1WI、短T2WI信号。Gd-DTPA增强扫描,囊虫存活期囊壁无强化;退变死亡期囊壁可明显强化。
脑池、颅底部蛛网膜下腔囊虫MRI表现为葡萄串样异常信号影,呈长T1WI、长T2WI信号,纤维间隔呈等T1WI、短T2WI信号,无囊虫头节。Gd-DTPA增强扫描,囊壁及间隔可轻度强化。

动脉磁敏感征
磁敏感加权成像(SWI)也称作高分辨率血氧水平依赖静脉成像,表现为在T1加权梯度回波或灌注成像等基于磁敏感性的成像序列图像上,低信号的动脉直径明显超过对侧相应动脉的直径,以大脑中动脉或基底动脉较为常见。
这种现象主要是由于颅内主要磁敏感改变与血液中铁的不同形式有关,含氧血红蛋白为反磁性物质,而脱氧血红蛋白、正铁血红蛋白和含铁血红素为顺磁性物质。
静脉结构成像依赖于其内脱氧血红蛋白引起磁场的不均匀性导致的血管与周围组织的相位差加大。根据这个原理,急性期血栓中含有大量的脱氧血红蛋白,为红色血栓的主要成分,因此SWI能够显示急性期血管内的血栓。
SWI对大脑中动脉近端闭塞(起始至发出豆纹动脉段)有很好的显示作用。表现为血管内信号降低,能够显示出沿血管走行的血栓影像,并且SWI显示的血栓直径均大于对侧血管的直径,这可能是由于血管壁的完整性遭到破坏,血液成分从血管中向外渗出的结果。
但是,当MCA远端闭塞时形成的红色血栓体积较小,尤其是血栓发生在已经有动脉硬化的狭窄管腔中,部分容积效应可能使血栓影像被掩盖,因而可能出现假阴性。

来源丨华夏影像诊断中心
【版权声明】本平台属公益学习平台,转载系出于传递更多学习信息之目的,且已标明作者和出处,如不希望被传播的老师可与我们联系删除
,